
|
4. 電流の化学作用と電池
4・1 電気分解
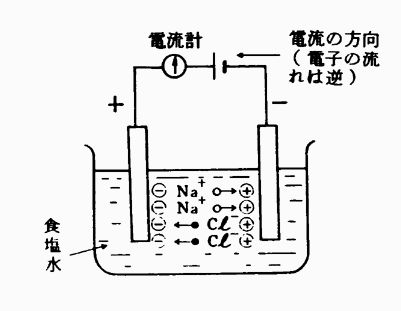
図4・1
図4・1において、この容器に蒸留水等の純水を入れておいて、電圧を加えても電流は流れない。ところが食塩水を入れると電流が流れ、電流計の針がふれる。
このことは食塩水が電気的に導体となるからである。これは何故か、その理由を考えてみよう。食塩水の分子はNaClからできている。
このように食塩が水に溶けた水溶液ではナトリウムNaは正電気を帯び、塩素Clは負電気を帯び、それぞれ陽と陰のイオンに分かれ自由に移動できるからNa+イオンは陰極へ、Cl-イオンは陽極へ移動する。このようにイオンによる電気伝導現象をイオン伝導という。
注:イオンを作っている原子又は原子団に、その原子価に等しい数の+を右肩につけ、陰イオンの場合は-をつける。
図4・1はNa+イオン及びCl-イオンの伝導現象を示したもので、これらのイオンが極に達し電荷を与えれば電気的に中性となる。
以上述べたように陽イオンと陰イオンに分離することを電離といい、水溶液中で電離する物質を電解質、また、電解質の水溶液を単に電解液といっている。酸、塩類、アルカリなどは一般に電解質である。両方のイオンがそれぞれ極板に達すれば、中性の原子又は分子となって極板上に析出し、いわゆる電気分解が行われる。そして電気分解には次の現象がともなう。
(1)そのまま電極の表面に析出して付着する。
(2)電極の表面からガスとなって液外に出る。
(3)電解物質又は溶液に作用して化学変化が起る。すなわち別の物質に変る。
電気分解の応用には電気めっき、電解精製、電解研磨等がある。
注:イオンについては1・4・2(3)参照のこと。
前ページ 目次へ 次ページ
|

|